
今日下午抵达国内!「瑞德西韦」会是新冠肺炎的“特效药”吗?
「瑞德西韦」,一个尚未面市、仍在研发中的药物,成为了国人的关注点。
这款药物的研发商是美国制药巨头吉利德科学,多次位列全球制药企业TOP10,一同入榜的还有罗氏、辉瑞、诺华、强生、葛兰素史克等等。
那么,「瑞德西韦」是怎么成为了抗击新冠的“新希望”?时间拨回到1月31日,美国的第一例新冠肺炎病人,在住院第7天开始使用瑞德西韦,次日退烧、症状减轻。这个消息被国际期刊《新英格兰医学杂志》所报道,更多人看到了瑞德西韦的治疗潜力。
带着新希望,瑞德西韦跨越大洋,开启了在中国的临床试验。试验预期于2月3日开始,入组轻、中度270例新冠肺炎患者。换句话说,在临床试验中,会有患者接受瑞德西韦治疗。
目前瑞德西韦在中国展开的是随机、双盲、对照III期临床试验,以评价该药抗击新冠的有效性和安全性。试验由中日友好医院曹彬教授牵头,持续到4月27日。
最新消息,国家卫健委表示,瑞德西韦在今日下午抵达国内。接下来的临床表现,我们拭目以待。
瑞德西韦为什么被看好?
美国的第一例新冠病人,经历了这样的一周:1月20日,在鼻咽和口咽拭子检测出2019-nCoV阳性后,病人被送往当地医疗中心。 他的症状包括发烧、咳嗽、乏力、呕吐和腹泻。在病人住院的第七天晚上,给他注射了瑞德西韦。 第二天,病人的食欲和血氧饱和度都有所改善。到1月30日,除了咳嗽,他的其他症状都消失了。
不仅是《新英格兰医学杂志》报道了瑞德西韦的案例,1月27日,国际期刊《科学》杂志也发表了文章“Can an anti-HIV combinationor other existing drugs outwit the new coronavirus?”,提出,瑞德西韦与单克隆抗体的联合用药,很可能是新冠病毒的理想疗法。
吉利德表示:“虽然目前没有抗病毒数据显示瑞德西韦对2019-nCoV(新冠病毒)的活性,但是瑞德西韦对SARS、中东呼吸综合征的病毒病原体,在体外实验和动物模型实验中均显示活性。SARS、中东呼吸综合征也属于冠状病毒,而且与2019-nCoV(新冠病毒)的结构相似。”
“瑞德西韦对我们测试过的每一种冠状病毒都有活性,如果它对2019-nCoV(新冠病毒)没有活性,那我才会很惊讶。”美国冠状病毒专家Mark Densison说道。
事实上,这种抗病毒疗法最初是为了应对埃博拉病毒而开发的,是与美国疾控中心、美国陆军医学研究所合作的结果。针对埃博拉病毒的Ⅲ期临床试验显示,接受瑞德西韦治疗的死亡率为53%,而未接受瑞德西韦治疗的死亡率为67% 。
由于冠状病毒与埃博拉病毒结构上相似,并且都具有瑞德西韦的作用靶点 —— RNA聚合酶RdRp,因此该药物也很可能抑制冠状病毒。
何时有望“出场”?
瑞德西韦当前的进展如何呢?在新冠疫情爆发之前,瑞德西韦已经在美国完成了针对埃博拉病毒的Ⅰ期、Ⅱ期试验,显示其毒副作用是可控的。
由于疫情紧迫,通过审批及伦理委员会审查,就紧急开始了在国内的Ⅲ期临床,以评价其抗击新冠的有效性和安全性。
当前,瑞德西韦刚刚开展了随机、双盲、对照Ⅲ期临床试验,临床试验预计4月27日结束。
36氪梳理了药物研发的各个环节。新药研发总共分为四个环节:首先,新药发现,主要是选择疾病和靶点,寻找和优化先导化合物,时间不定。第二步,临床前研究,在此阶段通常做动物实验和药理学研究,用时3-6年。第三步,临床研究,这个环节在做的事,是实验药物在人体内的影响,包括药代、药理、毒理、有效性等等。Ⅰ期、Ⅱ期、Ⅲ期下来通常要6-7年。第四步,注册审批、上市后检测,通常是半年至两年时间。
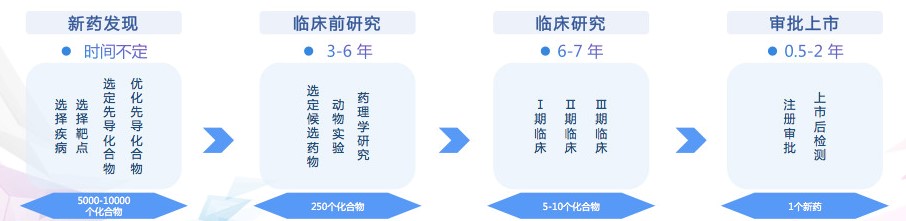
可以看到,瑞德西韦正处于Ⅲ期临床。如果Ⅲ期结果积极,瑞德西韦应该会通过国家药监局的审批而上市。
此前还没有美国公司的在研药物率先在中国上市的案例,但在日本、欧洲率先上市的先例都已经出现了。瑞德西韦可能会成为首例先在国内上市的美国公司的在研药物。
那么,瑞德西韦还未上市,怎么就可以先用到了病人身上了呢?这是得益于“同情用药”制度,在患者疾病严重或危及生命时,当现有药品不能带来有效治疗,或者患者无法入选临床试验来接受药物治疗时,可以申请在临床试验之外,使用未上市的试验用药物。
让人关心的是,本次临床试验仅入组了270名轻、中度患者,那么其他患者怎么紧急用药呢?36氪猜测,“同情用药”制度可能会是一种途径,使更多病人“有药可医”。不过,关于同情用药制度的相关政策,在国内仍然是征求意见稿。
更多研发进行时
不仅仅是瑞德西韦,还在试验中的药物还有克力芝、阿比朵尔等等。钟南山院士对外表示,现有至少7个针对病毒RNA聚合酶或蛋白酶的小分子药物,包括CR3022抗体药物都处于不同临床研究阶段;相关疫苗的研发也在开展中。

正在开展的部分临床试验(图片来源于中国临床试验注册中心)

 36氪 合作伙伴
36氪 合作伙伴